Un equipo de investigadores
del CONICET descubrió que
distintas especies de
bacterias resistentes
utilizan un mismo “modus 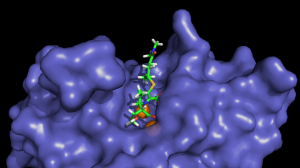

operandi” para degradar
antibióticos de última
generación. Esperan que el
hallazgo permita el
desarrollo de fármacos que
puedan suministrarse en
combinación con
carbapenemes.
Carolina Vespasiano
(Agencia CTyS-UNLaM) – La
Organización Mundial de la
Salud prendió la alarma:
para 2050, se prevé que la
mayor causa de muerte a
nivel mundial sean las
bacterias
multirresistentes:
microorganismos capaces de
degradar a distintos tipos
de antibióticos, con
diversos blancos de acción.
Un equipo del Instituto de
Biología Molecular y
Celular de Rosario (IBR-
CONICET), dirigido por el
Dr. Alejandro Vila, se hizo
eco de este desafío
contrarreloj y se propuso
estudiar los mecanismos de
resistencia a los
carbapenemes, la clase de
antibióticos ß-lactámicos
que actualmente se usa
como último recurso para el
tratamiento de infecciones
causadas por
“superbacterias”. ¿La
misión? Desarrollar
compuestos más eficaces
frente a distintas especies
bacterianas.
El problema es que algunas
“superbacterias” ya han
adquirido resistencia a los
carbapenemes. Las bacterias
resistentes a compuestos
ß-lactámicos producen una
proteína, la beta-
lactamasa, que destruye el
antibiótico, degradándolo.
Dentro de estas proteínas
hay distintas clases de
enzimas, entre ellas, las
metalo-beta-lactamasas
(MBLs), capaces de destruir
a los carbapenemes y para
las que todavía no existen
inhibidores que se puedan
usar clínicamente.
Como las MBLs tienen muchas
variantes, se creía que un
único compuesto no podría
bloquearlas a todas. Luego
de ocho años de estudio,
los investigadores
encontraron la clave:
descubrieron que todas
poseen un mismo mecanismo
químico, un idéntico “modus
operandi”, para degradar al
antibiótico.
“Con este hallazgo creemos
que, si un paciente se
infecta con una bacteria
que contiene estas enzimas,
no se necesitaría
determinar a priori con
cuáles de ellas cuenta: una
única combinación de
antibiótico inhibidor
podría tratar a todas”,
explica la Doctora Leticia
Llarrull, co-directora del
equipo, a Agencia CTyS-
UNLaM.
El estudio
Los investigadores se
valieron de una combinación
de técnicas de
biotecnología, bioquímica,
química computacional y
biofísica para observar
cómo es la reacción química
que se produce cuando el
antibiótico se enfrenta con
la proteína MBL y es
procesado por ella. “Lo que
identificamos es un punto
intermedio, en el interior
de la proteína, entre que
el antibiótico está en su
forma intacta y pasa a
estar en su forma
hidrolizada (destruida)”,
precisa la experta.
Para detectar ese
intermediario, mezclaron el
antibiótico con la enzima
en solo dos milisegundos, a
temperaturas muy bajas para
desacelerar la reacción e
irradiaron la mezcla con
luz visible y con rayos X
para observar lo que
ocurría dentro de la
proteína.
Este conocimiento de cómo
es el mecanismo químico
empleado por las MBLs para
destruir a los carbapenemes
es el punto de partida para
diseñar racionalmente
compuestos que puedan
bloquear la acción de estas
enzimas. El objetivo es
atacar específicamente los
mecanismos de reacción de
estas enzimas, volviendo a
las superbacterias
nuevamente susceptibles a
carbapenemes.
De hecho, el grupo ya está
trabajando, en conjunto con
investigadores de Uruguay,
Estados Unidos e
Inglaterra, en el
mejoramiento de una primera
familia de compuestos
inhibidores de estas
enzimas, de potencia
moderada, mediante
modificaciones químicas,
para volverlos más potentes
y poder así en un futuro,
si se prueba su eficacia y
seguridad, reducir las
dosis necesarias para
tratar las infecciones.
Una batalla colectiva
Según Llarrull, reducir los
riesgos por las
superbacterias no solo
depende de la investigación
y de la industria
farmacéutica. La revisión
de las prácticas de sanidad
en los hospitales, el
desarrollo y empleo de
técnicas rápidas de
identificación de bacterias
y del tipo de resistencia,
y la prescripción correcta
de tratamientos con
antibióticos, así como la
toma del antibiótico
completando el tiempo
indicado (aun cuando los
síntomas hayan
desaparecido), son factores
clave para evitar la
proliferación de
resistencias.
“Es necesario buscar
métodos de diagnóstico más
eficaces para detectar
rápidamente con qué
bacteria se está
enfrentando cada paciente”,
sostiene y explica que,
cuando no se realiza un
antibiograma antes de
suministrar un antibiótico
y se indica un antibiótico
de amplio espectro para una
infección que se puede
tratar con compuestos más
antiguos, como la
penicilina, se corre el
riesgo de que, en ese
paciente, otras bacterias
puedan adquirir resistencia
a la droga más potente, que
debería reservarse como
último recurso.
La experta resaltó la
importancia de fomentar
inversiones en este tipo de
investigaciones porque es
una problemática grave que
compromete el futuro y
requiere de prontas
respuestas. En este caso,
nuevos fármacos más
especializados.
El equipo se completa con
la Dra. María Natalia Lisa,
la Lic. Antonela Palacios,
Mariano González (quienes
desarrollaron su trabajo de
tesis doctoral en el IBR),
Diego Moreno (Instituto de
Química de Rosario, IQUIR),
en colaboración con
científicos de Estados
Unidos y Reino Unido.
Link a la nota:
http://www.ctys.com.ar/inde x.php? idPage=20&idArticulo=3478